Márcia R. Jardim
Introdução
A dor é uma experiência complexa que depende fortemente de influências cognitivas, emocionais e educacionais do indivíduo. Segundo a IASP (International Association for the Study of Pain), a dor é definida como uma desagradável experiência emocional associada a uma lesão tecidual real ou potencial ou descrita em termos de tal dano1. É um sintoma pouco específico de determinado processo de doença2.
A dor neuropática (DN) foi definida em 1994 pela Associação Internacional para o Estudo da Dor (IASP) como: ” dor iniciada ou causada por uma lesão ou disfunção primária no sistema nervoso ”. Essa definição foi amplamente criticada, principalmente por causa do termo “disfunção”, considerado por muitos especialistas como vago demais e uma fonte de ambiguidades de diagnóstico. Em particular, algumas dores crônicas associadas a condições não neurológicas, como fibromialgia ou síndromes intestinais irritáveis que envolvem disfunções centrais dos sistemas nociceptivos (por exemplo, sensibilização central e/ou alteração da modulação da dor), poderiam, em princípio, ser consideradas neuropáticas por esta definição.
Assim, em 2008, um grupo de especialistas propôs uma nova definição: ” dor que surge como consequência direta de uma lesão ou doença que afeta o sistema somatossensitivo ”3 , endossada pelo IASP em 2011. A restrição ao sistema somatossensitivo foi incluída na nova definição, a fim de distinguir a dor neuropática de outros tipos de dor, como dor musculoesquelética (por exemplo, dor relacionada à espasticidade) que pode estar associada a distúrbios do sistema motor. Finalmente, uma versão ligeiramente modificada, omitindo o termo “primário” por causa da dificuldade em separar causas primárias e secundárias, foi proposta pelo Comitê de Taxonomia do IASP e aceita pelo IASP4,5 .
Quando há retardo no diagnóstico deste processo a DN pode tornar-se crônica e em uma condição auto perpetuadora que permanece após a resolução da doença de base. Para Siddal e Cousins (2004) a definição de dor crônica é aquela que persiste além de três meses6. Evidências indicam que a dor crônica não pode ser vista como um sintoma passivo, uma vez que vai ter impacto na vida do indivíduo, provocando mudanças no humor, alterações cognitivas e ruptura social, tornando-a uma entidade de doença7.
A dor crônica, pode levar a incapacidade funcional que é difícil de quantificar, podendo resultar na perda de produtividade, perda de qualidade de vida, custos com reabilitação e despesas pessoais. Portanto é premente, além do reconhecimento da DN, proceder um diagnóstico etiológico cuidadoso para desvendar a causa da dor, evitando quando possível, a ocorrência de mais danos ao sistema somatosensitivo, o que, por si só pode resultar em alívio parcial ou total da dor, mas também evitar que ela se torne crônica8.
EPIDEMIOLOGIA DA DOR NEUROPÁTICA
Na população global, é difícil estimar a incidência e a prevalência de DN devido à falta de consenso sobre a sua definição. Em uma revisão sistemática da epidemiologia da dor crônica, foi encontrada uma prevalência entre 3% e 17%, enquanto a incidência foi calculada em 3,9 a 42,0 / 100.000 pessoas / ano para neuralgia pós-herpética; 12,6-28,9 / 100.000 pessoas por ano para neuralgia do trigêmeo; 15,3–72,3 / 100.000 pessoas / ano para PDN e 0,2–0,4 / 100.000 pessoas/ano para neuralgia do glossofaríngeo. Além disso, a dor neuropática foi mais prevalente entre as mulheres (60,5% dos pacientes), atingiu um pico entre 50 e 64 anos de idade e foi relatada com mais frequência por trabalhadores manuais, bem como entre pessoas de áreas rurais9 .
Fisiopatologia
I – Sensibilização Periférica
Ia -Mecanismos periféricos
A lesão do nervo periférico resulta em processos inflamatórios e reparatórios. Ao longo do tempo este processo leva a hiperexcitabilidade do axônio, fenômeno reconhecido como sensibilização periférica devido a redução do limiar do potencial de ação dos neurônios aferentes primários. Na maioria dos pacientes esse estado desaparece à medida que há resolução do processo patológico e a inflamação diminui.
Entretanto quando ocorre agressões ao nervo periférico de forma repetida ou contínua devido ao processo da doença (o que ocorre por exemplo no diabetes) as alterações nos neurônios aferentes primários podem persistir, resultando em alterações morfológicas nos axônios. De uma maneira geral, os mecanismos fisiopatológicos geralmente são desconhecidos e dependem da doença de base, podendo decorrer de doenças metabólicas, infecciosas, inflamatórias e genéticas9,10,11 .
Ib. Atividade ectópica
Após a lesão nervosa e a consequente hiperexcitabilidade axonal, especialmente das fibras pouco mielinizadas A-delta (A-δ) e as fibras amielínicas C, ocorrem potenciais de ação ectópicos em neurônios aferentes primários e, às vezes, em suas projeções centrais, especialmente nos gânglios da raiz dorsal.
As fibras preservadas aumentam a expressão de canais de Na+. Evidências apontam para várias alterações moleculares que provavelmente contribuem para a atividade ectópica, incluindo alterações pós-lesão nos canais de sódio voltagem dependentes (por exemplo, Nav1.3, Nav1.6 e Nav1.9), canais de potássio voltagem dependente (por exemplo, KCNQ Kv7) e hiperpolarização de canais ativados por nucleotídeos cíclicos ativados (por exemplo, HCN2)12.
Este mecanismo provavelmente é um importante gerador de parestesias, disestesias e dores espontâneas (independentes de estímulos) que podem apresentar diferentes padrões temporais de dor (por exemplo, paroxística breve, intermitente contínua ou constante contínua). Os bloqueadores dos canais de sódio, como a fenitoina, a carbamazepina, a oxcarbazepina, a lamotrigina, o topiramato, a lidocaína e os antidepressivos tricíclicos tem como mecanismo de ação este processo fisiopatogênico 8,10,11.
II – Sensibilização Central
As doenças ou lesões nervosas, bem como outros estímulos nociceptivos periféricos, também podem desencadear alterações neuroplásticas centrais (espinhais e supraespinhais), fenômeno reconhecido como sensibilização central. Sensibilização central foi definida como “um aumento prolongado, porém reversível, da excitabilidade e eficácia sináptica dos neurônios nas vias nociceptivas centrais”.
Quando há lesão do sistema somatossensitivo, pode ocorrer um aumento da expressão de canais de cálcio nas terminações das fibras nociceptivas da medula espinhal estimulando a liberação de glutamato ativando neurônios centrais.
Isto leva a sensibilização das fibras A-beta (Aβ) e interneuronios medulares11. Outros mecanismos propostos pelos quais a lesão nervosa resulta em sensibilização central incluem alterações fenotípicas nas fibras A-β, que subsequentemente expressaram níveis aumentados de neuropeptídeos como peptídeo relacionado ao gene da calcitonina e aumento da atividade de transmissão excitatória de aminoácidos (por exemplo, via receptores N-metil-D-aspartato [NMDA]).
Pode se manifestar clinicamente como alodinia (dor evocada pelo toque), hiperalgesia (experiência de dor exagerada em relação a um estímulo nocivo padronizado), somação temporal aprimorada (aumento da dor em resposta a aplicações repetidas) e hiperalgesia secundária (dor e hipersensibilidade além do dermátomo da lesão nervosa)8.
Os bloqueadores de canais de cálcio como a gabapentina, a oxigabapentina e a pregabalina, são medicações que tem como mecanismo de ação este processo fisiopatogênico.
Modulação Inibitória Prejudicada
Além de alterações que aumentam o estímulo nociceptivo, evidências indicam que a lesão do sistema somatosensitivo pode levar ao comprometimento dos mecanismos inibitórios endógenos da nocicepção. Por exemplo, a transmissão excitatória nociceptiva pós-lesão tem sido relacionada a apoptose de interneurônios inibidores da coluna vertebral GABAérgicos, contribuindo ainda mais para a sensibilização à dor pós-lesão de condições neuropáticas assim como em outros estados de dor crônica.
Também estão associadas à ativação da glia e de outras células não neuronais no sistema nervoso central (SNC) e, além disso, as alterações nestas células gliais ativadas podem ser fatores importantes para o fenômeno da sensibilização central.
Várias alterações moleculares resultantes da ativação glial pós-lesão foram identificadas contribuindo para a hipersensibilidade à dor, a regulação positiva dos receptores de quimiocinas e a liberação de citocinas gliais assim como fatores de crescimento do nervo8,11.
Os sinais nociceptivos também podem ser alterados nos segmentos supraespinhais. O cérebro (tálamo e córtex cingulado) dos pacientes com dor crônica são diferentes daqueles indivíduos sem dor, com variações no metabolismo e concentrações regionais de neurotransmissores.
Variam de acordo com o tipo de dor experimentada (por exemplo, dor aguda ou alodinia). A reorganização cortical que ocorre após lesão neuropática e a extensão da condução das vias nociceptivas parecem correlacionar-se com o grau e intensidade da dor.
Essas alterações que ocorrem após a lesão sugerem que a desinibição (modulação inibitória prejudicada) pode não apenas ser uma consequência da lesão da via nociceptiva, mas também pode tornar os pacientes mais suscetíveis à dor crônica. As alterações que ocorrem nas regiões supraespinhais podem explicar a forte associação entre dor neuropática e transtornos do humor.
Os pacientes com dor crônica apresentam redução da massa cinzenta em comparação com pacientes controle, e isso pode ser parcialmente revertido pelo tratamento8,11.
Medicações como os antidepressivos tricíclicos, a duloxetina, o tramadol e os opióides tem como mecanismo de ação a via modulação inibitória.
Diagnóstico
O diagnóstico da DN é baseado em critérios clínicos já que não existem biomarcadores. O desafio é diferenciar a dor neuropática de outros tipos de dor, além de identificar a lesão ou doença potencialmente causadora da dor. Os pacientes podem apresentar várias combinações de sintomas, incluindo dor espontânea, dor contínua ou paroxística e evocada.
A dor evocada, que pode ser mais angustiante do que a espontânea, é denominada alodinia quando é desencadeada por estímulos normalmente não nocivos e hiperalgesia quando corresponde a uma resposta exagerada a um estímulo normalmente nocivo.
A dor evocada pode ser desencadeada por estímulos mecânicos ou térmicos. A alodinia mecânica pode ser preferencialmente desencadeada por estímulos em movimento (isto é, mecano alodinia dinâmica) ou por pressão ou estímulos pontuados (isto é, mecano alodinia estática).
A dor evocada também pode ser desencadeada por estímulos térmicos, tanto de calor quanto de frio, mas a alodinia/hiperalgesia fria é muito mais frequente do que a alodinia/hiperalgesia por calor nesses pacientes5,13.
O exame clinico visa detectar possíveis anormalidades sugestivas de lesão do sistema somatossensitivo, principalmente déficits sensitivos térmicos e/ou mecânicos. É importante enfatizar que o exame físico não pode comprovar que a dor é neuropática, apenas fornece evidências de suporte para uma lesão ou doença neurológica que pode ser potencialmente a causa da dor.
Além disso, a dor localizada em uma área de déficit sensitivo não é necessariamente neuropática (por exemplo, dor isquêmica ou dor de osteoartrite nos membros inferiores de pacientes com neuropatia diabética ou dor espástica em pacientes com esclerose múltipla)11.
Vários exames complementares, como eletroneuromiografia, testes sensitivos quantitativos, imagem do cérebro ou da medula espinhal, bioquímica, biópsias de nervo ou pele, podem ser usados, dependendo do contexto clínico, para identificar e caracterizar a lesão neurológica potencialmente subjacente à dor.
No entanto, esses testes não medem a dor em si e não podem confirmar diretamente a relação causal entre a lesão identificada e a dor. O diagnóstico de dor neuropática é, portanto, ainda dependente do julgamento clínico e da interpretação dos resultados dos exames em um contexto clínico específico5.
Existem várias ferramentas utilizadas para auxiliar o diagnóstico da DN, por exemplo, Michigan Neuropathy Screening Instrument, Neuropathic Pain Scale, Leeds Assessment of Neuropathic Symptoms and Signs (LANSS), Neuropathic Pain Questionnaire, Neuropathic Pain Symptom Inventário, “Douleur Neuropathique em 4 perguntas” (DN4), Pain DETECT, Pain Quality Assessment Scale, Short-Form McGill Pain Questionnaire.
Entre estes métodos, o questionário DN4 é um dos mais utilizados, é composto por perguntas simples e a identificação de sintomas bem distribuídos por todo o questionário, o que facilita o entendimento pelo paciente e reconhecimento do médico5 .
Além das escalas que ajudam no diagnóstico da DN é importante utilizar alguma forma de escala que auxilie na quantificação da intensidade da dor, já que a resposta terapêutica será baseada neste parâmetro. Mais uma vez existem vários tipos de escalas que devem ser utilizadas de acordo com a experiência de cada profissional ou serviço.
Dentre elas estão a Escala Analógica visual, a Escala Numérica, a Escala Descritiva, Escala de Copos e Escala de Faces11.
Tratamento
No contexto do tratamento da DN é importante identificar e localizar o processo patogênico desencadeante na expectativa de que o tratamento da doença de base leve a sua resolução. Entretanto mais de um mecanismo fisiopatogênico de DN ou fenótipo de dor pode estar presente em um indivíduo. Portanto a individualização do tratamento é um exercício diário no acompanhamento destes pacientes11.
A escolha terapêutica depende da experiência medicamentosa prévia do paciente, doenças associadas e sintomas concomitantes, além do custo e efeitos adversos relacionados a medicação. Antidepressivos e anticonvulsivantes são as duas classes de drogas mais estudadas e consideradas de primeira-linha terapêutica para DN, mas o número de agentes farmacológicos que têm demonstrado eficácia no tratamento da DN continua a se expandir14.
Até o momento, não foram identificados preditores claros de resposta ao tratamento em pacientes com dor neuropática. Além disso, precisamos compreender melhor os mecanismos e ações destas medicações. Assim, a abordagem terapêutica geral ainda é um processo passo a passo para identificar quais medicamentos ou combinações de medicamentos proporcionam o maior alívio da dor com o menor número de efeitos colaterais, particularmente porque a dor neuropática geralmente afeta pacientes idosos com várias morbidades. O conhecimento e manuseio de possíveis efeitos colaterais dos medicamentos, é importante para aumentar a adesão do paciente. Além disso é importante traçar metas realistas de tratamento – a redução em 30% da intensidade da dor já é considerada um resultado clinicamente significativo. Distúrbios do sono e a qualidade de vida relacionada à saúde, incluindo o funcionamento social e emocional, devem ser avaliados ao analisar a eficácia analgésica11,15.
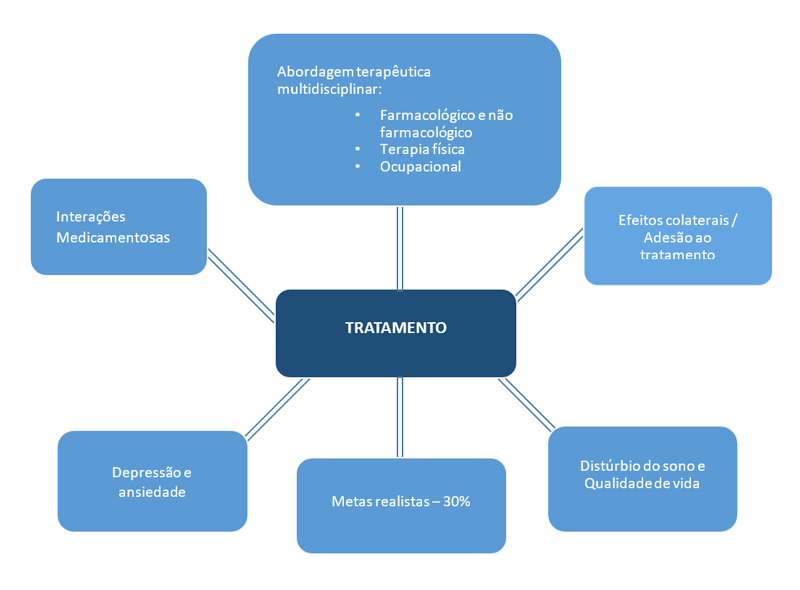
É importante uma abordagem terapêutica interdisciplinar, o tratamento farmacológico e não farmacológico, como terapia cognitivo-comportamental, física e ocupacional. Embora a eficácia desse conceito biopsicossocial multidisciplinar tenha sido tipicamente relatada em estados de dor crônica que não sejam neuropáticos, seu benefício no grupo de pacientes com DN também é bem aceito. Além do controle dos sintomas, o tratamento de pacientes com DN exige reavaliação periódica para descartar outras condições médicas subjacentes tratáveis, educação do paciente e segurança. Por exemplo, o encaminhamento e o tratamento simultâneo por um profissional, reabilitação ocupacional ou fisioterapeuta podem ser úteis nos casos em que a dor interfere substancialmente no trabalho e outras atividades diárias. Além disso, a avaliação precoce de distúrbios coexistentes de depressão, ansiedade e / ou abuso de outras substâncias pode facilitar o encaminhamento precoce a um psicólogo, psiquiatra e / ou clínica de tratamento da dor no atendimento terciário15. (Figura 1)
Ao iniciar o tratamento sintomático, é importante a educação dos pacientes, incluindo informações sobre dor neuropática, o plano de tratamento e possíveis efeitos colaterais dos medicamentos, para aumentar a adesão ao tratamento (figura 2).
Figura 1. Drogas e sitio de ação no tratamento da dor neuropática.
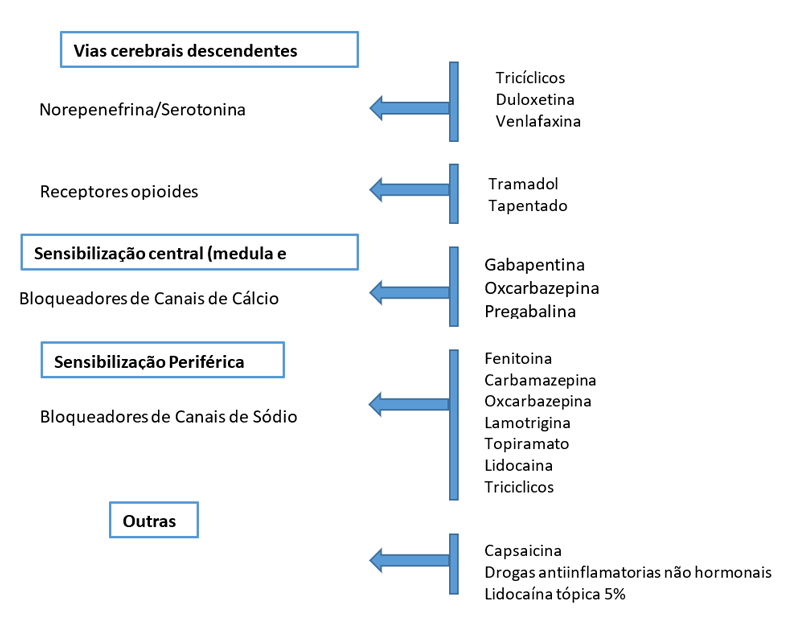
Figura 2 – Manuseio da dor neuropática
Terapia Combinada
O regime de monoterapia é o ideal, pois deve equilibrar a analgesia com danos em termos de efeitos colaterais, comorbidades e interações medicamentosas. Entretanto na prática clínica, muitas vezes é necessária uma combinação de dois ou mais medicamentos para alcançar um alívio satisfatório da dor. Deve-se, portanto, observar mecanismo de ação de cada uma das drogas assim como a sobreposição/exacerbação de efeitos colaterais com a associação das medicações. O objetivo deve ser melhorar a eficácia analgésica e reduzir os efeitos colaterais de medicamentos individuais. Não existem evidências suficientes para recomendar uma combinação específica de medicamentos11,15.
Outras Terapias:
Algumas terapias não medicamentosas são utilizadas no manuseio destes pacientes.
I – Estimulação Elétrica do Nervo (TENS)
Embora os dados sejam limitados, uma declaração de 2010 da Academia Americana de Neurologia (AAN) avaliando o uso da TENS para DN concluiu que o seu uso é provavelmente eficaz para reduzir a DN na neuropatia diabética16 . Esta recomendação foi ratificada em 2011 pela AAN que também avaliou o tratamento da DN na neuropatia diabética. No entanto, as técnicas percutâneas avaliadas nas diretrizes da AAN 2011 não estão amplamente disponíveis na prática clínica17.
II -ESTIMULAÇÃO DA MEDULA ESPINHAL
A estimulação da medula espinhal ou estimulação da coluna dorsal é uma técnica invasiva que envolve a estimulação das colunas dorsais da medula espinhal através da administração de impulso em frequências de cerca de 50Hz (por um gerador de pulsos implantados) capazes de suprimir a hiperexcitabilidade neuronal central (sensibilização central). Os eletrodos podem ser inseridos por via percutânea através de agulha epidural ou implantada cirurgicamente por laminotomia. Constitui outra terapia alternativa útil para pacientes que não respondem ao tratamento medicamentoso. Dados preliminares de um pequeno estudo aberto sugerem que a estimulação da medula espinhal reduz a DN em pacientes com neuropatia diabética refratária. Mais estudos são necessários para confirmar a eficácia dessa abordagem. A estimulação das fibras de grande diâmetro na coluna dorsal induz parestesia, para evitar este efeito colateral, tem sido proposto novos parâmetros elétricos. Como uma técnica de estimulação em rajada, que consiste em administrar cinco pulsos intermitentes de alta frequência de 500 Hz. A estimulação da medula espinhal pode ser considerada uma opção de tratamento válida, eficaz e segura em pacientes que sofrem de DN crônica resistente a tratamentos farmacológicos17.
III – ESTIMULAÇÃO TRANSCRANIANA NÃO INVASIVA DO CÉREBRO
Técnicas de estimulação transcraniana não invasiva do cérebro são uma outra forma de abordagem terapêutica em pacientes com DN crônica refratária ao tratamento farmacológico e incluiu estimulação magnética transcraniana repetitiva (EMTr) e estimulação transcraniana por corrente contínua (tDCS). O rTMS produz correntes elétricas no córtex através de um campo magnético transitório. O estudo da dor de membro fantasma em vítimas de minas terrestres mostrou a capacidade de EMTr de alta frequência (10Hz) para reduzir a dor significativamente até 15 dias após o tratamento. Este ensaio clínico demonstrou que o uso de estimulação magnética espinhal repetitiva (EMTr) como uma opção terapêutica em pacientes com dor neuropática intratável dos membros inferiores. O efeito analgésico ficou evidente imediatamente após o tratamento (200 trens de cinco pulsos de 10 Hz) e um efeito residual foi observado até 4 dias após o tratamento. A estimulação tDCS (elétrica corrente de 1-2 mA) foi relatada como tendo um efeito benéfico no tratamento de DN associada ao diabetes, lesão medular traumática e fibromialgia18,19,20.
IV – TOXINA BOTULINICA (TXB) TIPO A NA DOR NEUROPÁTICA
Estudos clínicos têm demostrado a eficácia do uso da TXB em diferentes condições neurológica, em particular aquelas que cursam com dor neuropática, tais como: neuralgia pós-herpética, neuropatia diabética, síndrome dolorosa regional complexa, neuralgia do trigêmeo, dor crônica facial21,22. A TXB pode ser considerada uma droga segura e, de uma maneira geral, apresenta efeitos adversos leves relacionados à absorção de pequenas quantidades de TXB para a corrente sanguínea Os mecanismos de ação descritos são: 1) iinibição da liberação de mediadores da dor a partir dos terminações nervosas periféricas, gânglios da raiz dorsal e neurônios da medula espinhal; 2) Redução local do processo inflamatório através da inibição da liberação de mediadores inflamatórios; 3) inibição dos canais de sódio nos axônios e 4) Otimização do transporte axonal da periferia para o sistema nervosa central23,24. A vantagem do uso de TBX é a manutenção efeito após uma única aplicação além do baixo risco de efeitos adversos, mesmo em administrações repetidas. A TXB pode ser considerada uma droga segura25.
O Futuro do tratamento da DN
Apesar da disponibilidade dos recursos terapêuticos descritos acima, algumas vezes o tratamento da DN ainda tem eficácia moderada e apresenta efeitos colaterais que impossibilitam a continuidade do tratamento, sendo necessário outras opções de tratamento. Existem em andamento vários ensaios clínicos para o tratamento da DN visando melhorar a eficácia terapêutica. Alguns novos medicamentos sob investigação (estudos pré-clínicos) ainda não aprovados pelo FDA (Food Drug Admistration) incluem a cetamina, memantina e N-metil-d-aspartato antagonistas dos receptores NMDAR26.
I – CANABINÓIDES
Alguns estudos clínicos sugerem a eficácia dos derivados da Cannabis sativa na modulação da dor neuropática27. Cannabis sativa é uma planta complexa que contém cerca de 100 canabinóides. O mais investigado entre os canabinóides é o delta-9-tetra-hidrocanabinol (Δ-9-THC) por suas propriedades psicoativas. Recentemente, uma mistura (1:1) de Δ-9-THC e canabidiol (CBD) em uma formulação de spray oromucoso (Sativex®; GW Pharma Ltd, Salisbury, Reino Unido) licenciada para melhoria dos sintomas de espasticidade na esclerose múltipla foi desenvolvida. O Sativex foi usado em ensaios clínicos, controlados com placebo, e seu efeito benéfico foi revelado na dor central da esclerose múltipla (NCT01604265; NCT00391079), dor neuropática após lesão periférica (NCT00711880; NCT00710554) e neuropatia diabética (NCT00710424)28,29,30. A maioria das diretrizes apresenta recomendações para neuropatia crônica dor e relatam que os medicamentos à base de cannabis podem ser considerados um opção de tratamento para pacientes com DN mas com algumas ressalvas. O potencial de eventos adversos associados aos medicamentos à base de cannabis precisa ser considerado. Populações específicas de pacientes podem ser mais vulneráveis a efeitos adversos do medicamento. São necessários estudos de alta qualidade e com maior duração para determinar definitivamente a eficácia clínica e a sua segurança31.
II – TERAPIA DE CÉLULAS TRONCO
As células-tronco estão atraindo a atenção como um elemento-chave na medicina futura, satisfazendo o desejo de viver uma vida mais saudável, com a possibilidade de regenerar tecidos danificados ou degenerados por doenças ou envelhecimento. As células-tronco são definidas como células indiferenciadas que têm a capacidade de se replicar e se diferenciar em várias células dos tecidos. As células-tronco, comumente encontradas em estágios clínicos ou pré-clínicos, são classificadas como células-tronco pluripotentes embrionárias, adultas e induzidas. Recentemente, o transplante de células-tronco tem sido frequentemente aplicado ao tratamento da dor como uma abordagem alternativa para o tratamento da osteoartrite grave, DN e dor musculoesquelética intratável que não responde à medicina convencional. O objetivo de aplicar células-tronco à dor neuropática é baseado na capacidade das células-tronco de liberar fatores neurotróficos, além de fornecer uma fonte celular para substituir as células neurais lesionadas, tornando-as candidatas ideais para modular e possivelmente reverter a DN intratável. Entretanto ainda não há conhecimento e técnica disponíveis para controlar a diferenciação em tecidos desejados32.
III – BLOQUEADORES ESPECÍFICOS DOS CANAIS DE SÓDIO
Embora a percepção consciente da DN ocorra no sistema nervoso central, o sistema nervoso periférico (SNP) através da hiperexcitabilidade da via nociceptora induzida por lesão nervosa é suficiente e necessário para iniciar e manter a DN. A gênese e a propagação de potenciais de ação no SNP dependem dos canais de sódio voltagem dependentes, em particular Nav1.7, Nav1.8 e Nav1.9. No entanto, a lesão nervosa desencadeia mudanças em sua distribuição, expressão e/ou propriedades biofísicas, levando a aberrações em sua excitabilidade. A maioria dos tratamentos existentes para alívio da DN atua através do bloqueio não seletivo e independente do estado do canal de sódio e possui janelas terapêuticas estreitas. Novos estudos para o desenvolvimento de analgésicos para o tratamento da DN, incluem terapia combinada e terapia genética que visam o desenvolvimento de bloqueadores de canal de sódio subtipo-específicos e moleculares com efeitos colaterais mínimos12.
IV – TERAPIA INDIVIDUALIZADA
A perspectiva é de que no futuro a terapia da DN seja mais individualizada, a busca por novos opioides de ação mais seletiva, mais seguros que os compostos clássicos, mas com eficácia analgésica similarmente forte, está em sua infância, mas os resultados das pesquisas iniciais são encorajadores. Potencialmente, o direcionamento de múltiplos receptores com um único composto pode representar uma abordagem mais promissora para o desenvolvimento de novos analgésicos. As disponibilidades coletivas de novas abordagens em combinação com a descoberta clássica de medicamentos baseados em diferentes alvos podem finalmente expandir as possibilidades farmacológicas para o desenvolvimento de novos analgésicos para o alívio da dor persistente33.
BIBLIOGRAFIA
- http://www.iasp.porg/Content/NavigationMenu/GeneralResourceLinks/PainDefinitions/default.htm#Pai
- Giesel,LM, Pitta IJR, Silveira RC, Andrade, LR, Vital RT, Nery JAC, Hacker MVB, Sarno EM, Jardim MR. Clinical and Neurophysiological Features of Leprosy Patients with Neuropathic. Am. J. Trop. Med. Hyg., 98(6), 2018, pp. 1609–1613.
- Loeser, John D.A; Treede, Rolf-Detlef. Pain Terminology. Pain: July 31, 2008,vol 137,3,p437-477.
- Rolf-Detlef Treede. The International Association for the Study of Pain definition of pain: as valid in 2018 as in 1979, but in need of regularly updated footnotes. Pain Rep. 2018 Mar; 3(2): e643
- Bouhassira, B Neuropathic pain: Definition, assessment
and epidemiology . Rev Neurol (Paris). 2019 Jan – Feb;175(1-2):16-25). Gilron I, Baron R., Jensen T. Neuropathic Pain: Principles of Diagnosis and
Mayo Clin Proc. 2015;90(4):532-545 - Siddall PJ, Cousins MJ. Persistent pain as a disease entity: implications for clinical management. Anesth Analg. 2004 Aug;99(2):510-20
- Cruccu G, Anand P, Attal N, Garcia-Larrea L, Haanpää M, Jørum E, Serra J, Jensen TS., EFNS guidelines on neuropathic pain assessment. Eur J Neurol. 2004 Mar;11(3):153-62
- Cohen S, Mao J. Neuropathic pain: mechanisms and
their clinical implications. BMJ 2014;348:f7656) - Carey, T.S.; Evans, A.T.; Hadler, N.M.; Lieberman, G.; Kalsbeek, W.D.; Jackman, A.M.; Fryer, J.G.; MCNutt, R.A. Acute severe low back pain. A population-based study of prevalence and care-seeking. Spine (Phila Pa 1976), [S.l.], .v. 21, n. Suppl. 3, p. 339-344, 1996.
- Baron R, Binder R, Wasner G. Neuropathic pain: diagnosis, pathophysiological mechanisms, and treatment . Lancet Neurol 2010; 9: 807–19.
- Gilron I, Baron R., Jensen T. Neuropathic Pain: Principles of Diagnosis and Treatment. Mayo Clin Proc. 2015;90(4):532-545
- Ma R.S.Y., Kayani K. Whyte-Oshodi D. Whyte-Oshodi A. Nachiappan N. Gnanarajah S. Mohammed R. Voltage gated sodium channels as therapeutic
targets for chronic pain. Journal of Pain Research, 2019:12 2709-2722). - Barrell K, Smith G. Peripheral Neuropathy. Med Clin N Am 103 (2019) 383–397.
- Wolfe GI, Trivedi JR. Painful peripheral neuropathy and its nonsurgical treatment. Muscle Nerve. 2004 Jul;30(1):3-19
- Macone A., Otis J.A.D, Neuropathic Pain, Semin Neurol 2018;38:644–653.
- Dubinsky RM, Miyasaki J. Assessment: efficacy of transcutaneous electric nerve stimulation in the treatment of pain in neurologic disorders (an evidence-based review): report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. 2010 Jan 12;74(2):173-6.
- Xu L, Zhang Y, Huang Y. Advances in the Treatment of Neuropathic Pain. Translational Research in Pain and Itch, Advances
in Experimental Medicine and Biology 904. Springer Science+Business Media Dordrecht 2016. - Ramger BC, Bader KA, Davies SP, Stewart DA, Ledbetter LS, Simon CB, Feld JA. Effects of Non-InvasiveBrain Stimulation on Clinical Pain Intensity and Experimental Pain Sensitivity Among Individuals with Central Post-Stroke Pain: A Systematic Review. J Pain 2019 Dec 13;12:3319-3329;
- Herrero Babiloni A, Guay S, Nixdorf DR, de Beaumont L, Lavigne G. Non-invasivebrain stimulation in chronic orofacial pain: a systematic review. J Pain 2018 Aug 1;11:1445-1457.
- Moisset X, Lefaucheur JP Nonpharmacological treatment for neuropathic pain: Invasive and non-invasive cortical Rev Neurol (Paris). 2019 Jan – Feb;175(1-2):51-58.
- Hauser W, Finn DP, Kalso E, et al. European Pain Federation (EFIC) position paper on appropriate use of cannabis-based
medicines and medical cannabis for chronic pain management. Eur J Pain. 2018;22(9):1547-1564 - Deng Y, Luo L, Hu Y, Fang K, Liu J. Clinical practice guidelines for the management of neuropathic pain: a systematic
BMC Anesthesiol. 2016;16:12. - Meng, J.; Wang, J.; Lawrence, G.; Dolly, J.O. Synaptobrevin I mediates exocytosis of cgrp from sensory neurons and inhibition by botulinum toxins reflects their anti-nociceptive potential. Cell Sci. 2007, 120, 2864–2874.
- Durham, P.L.; Cady, R. Insights into the mechanism of onabotulinumtoxinA in chronic migraine. Headache 2011, 51, 1573–1577.
- Matak I,, Bölcskei K, Bach-Rojecky L, Helyes Z. Mechanisms of Botulinum Toxin Type A Action
on Pain Toxins 2019, 11, 459. - Cavalli E, Mammana S, Nicoletti F, Bramanti P, Mazzon E. The neuropathic pain: An overview of the
current treatment and future therapeutic
Int.J.ofImmunopathol.andPharmVolume33:1–10 2019. - Deng Y, Luo L, Hu Y, Fang K, Liu J. Clinical practice guidelines for the management of neuropathic pain: a systematic
BMC Anesthesiol. 2016;16:12. - Giacoppo S, Bramanti P, Mazzon E. Sativex in the management of multiple sclerosis-related spasticity: An overview of the last decade of clinical evaluation. Mult Scler Relat Disord.2017 Oct;17:22-31.
- MacDonald E, Adams A The Use of Medical Cannabis with Other Medications: A Review of Safety and Guidelines – An Update. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019 Sep. CADTH Rapid Response Reports. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019 Sep. CADTH Rapid Response Reports.
- Hauser W, Finn DP, Kalso E, et al. European Pain Federation (EFIC) position paper on appropriate use of cannabis-based
medicines and medical cannabis for chronic pain management. Eur J Pain. 2018;22(9):1547-1564. - Houze B, El-Khatib H, Arbour C. Efficacy, tolerability, and safety of non-pharmacological therapies for chronic pain: An
umbrella review on various CAM approaches. Neuropsychopharmacol Biol Psychiatry 2017;79(Pt B):192-205. - Sisignano M., Parnham M.J., Geisslinger G. Novel Approaches to Persistent Pain Therapy. Trends in Pharmacological Sciences, June 2019, Vol. 40, No. 6.
- Sisignano M., Parnham M.J., Geisslinger G. Novel Approaches to Persistent Pain Therapy. Trends in Pharmacological Sciences, June 2019, Vol. 40, No. 6